产品单价 |
1.00元 |
起订量 |
1000 |
供货总量 |
10000 |
发货期限 |
自买家付款之日起3天内发货 |
品牌 |
检测试剂CE |
体外诊断CE |
试剂CE认证 |
检测试剂CE认证流程
今天是出口欧盟的国内厂家欢喜的一天。2021年10月14日,在距离IVDR正式实施仅剩几个月的时候,欧盟发布推迟IVDR实施的提案。该提案对于目前IVDR的实施进度进行了分析,截止2021年9月9日的数据,全球仅有31张IVDR证书(B类和C类)发出,尚无任何D类证书发出。
这一消息利好了国内厂家,可以继续延用IVDD other 类的CE符合性申明,欧盟注册出口欧盟。
在IVDD时期需要公告机构参与的器械大概在3300种,该数据在IVDR下增加到24000种。按照原计划,NB没有足够能力及时受理,可能会导致市场断货的风险。
IVDR 延期内容
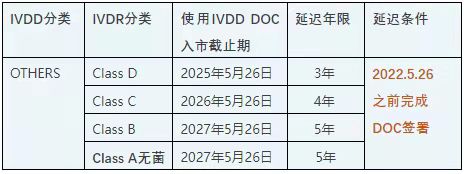
1. 根据IVDD指令98/79/EC获得公告机构CE证书的IVD器械(List A, List B, 自测类器械)晚使用期限为2025年5月26日。
2. 根据IVDD指令98/79/EC无需公告机构介入,而在新的IVDR法规2017/746需要公告机构开展合格评定的器械:
关注提醒:
1)》虽然IVDR的实施日期延迟,但使用IVDD DOC投放市场使用的IVD产品,其上市后监督,在2022年5月26日开始就应参照IVDR法规中上市后监督相应的要求实施。
2)》》》在IVDD属于OTHER类别同时在新版IVDR法规里属于自我声明的A类非灭菌器械依然需在2022年5月26日前完成转换。
体外诊断企业如何应对IVDR的延期?
《对于IVDD和IVDR均不需要公告机构参与的IVD器械制造商,应尽快按照IVDR 2017/746来完成合规程序。程序包括:
1) 按照IVDR 2017/746编制技术文件;
2) 欧盟授权代表;
3) 完成IVDR 2017/746器械注册;
4) 发布DOC文件;
5) 按照IVDR 2017/746执行上市后监督体系。
对于IVDD不需要公告机构参与,但是IVDR需要公告机构参与的IVD器械制造商,应尽快(在2022年5月26日之前)按照IVDD来完成DOC以获得缓冲期资格。
程序包括:
1) 按照IVDD 98/79/EC编制技术文件;
2) 欧盟授权代表;
3) 完成IVDD 98/79/EC器械注册;
4) 发布DOC文件;
5) 按照IVDR 2017/746执行上市后监督体系。
检测试剂厂家在这延期档口上,建议马上把已经生产的产品陆续完成欧盟注册和DOC签署,以免造成被动,失去欧盟市场。
| 上海沙格企业管理咨询有限公司广州分公司 | |||
|---|---|---|---|
| 联系人 | 王瑞芬 |
微信 | 无 |
| 手机 | ����������� | 邮箱 | 81042498@qq.com |
| 传真 | 无 | 地址 | 广州市天河区天河北路620号2604房,2603房(仅限办公用途) |
| 主营产品 | 美国fda注册,欧盟ce认证 | 网址 | /qiye2884368/ |