产品单价 |
面议 |
起订量 |
1 |
供货总量 |
不限量 |
发货期限 |
自买家付款之日起3天内发货 |
品牌 |
MDR CE |
口罩CE |
口罩欧代 |
道路千万条,合规条。
注册不规范,未来两行泪。
违法的后果:欧盟将通知全球认证机构禁止接收该企业任何产品的认证、通知海关禁止该企业全部产品进入欧盟境内及追究企业的法律责任。


1、欧洲市场口罩分类:
1)防护用品类(PPE):依据REGULATION (EU) 2016/425,口罩属于Class III,对应的欧洲标准主要为EN149。PPE分为I类、II类和III类,I类自我符合性声明,II类和III类需要公告机构介入。
2)医疗器械类(medical mask):依据DIRECTIVE 93/42/EEC(MDD)或者EU 2017/745(MDR),分类: Class I和Class Is,对应的欧洲标准主要为EN14683,Class I不需要公告机构介入。


2、口罩认证途径:
1)PPE类:


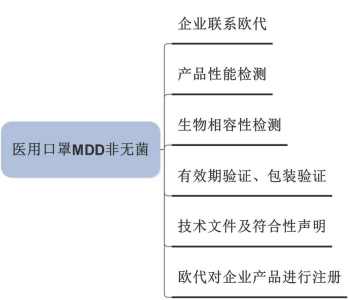
2)医疗器械类


3、PPE途径认证的难点及风险点:
1) 按防护类产品进行CE认证需要产品EU型式检验和公告机构审核,需要考虑检测周期和审核时间,目前我们所了解的几家认证机构给出的时间均在2个月以上。
2) 国内的防护口罩的检测报告并不能完全覆盖EN149的要求,因此企业需要按照EN149的要求重新检测,而且只能选择有资质的单位进行检测,否则报告被认为是无效的。
3) 作为PPE认证的产品,在写产品的用途、设计标签和说明书时一定要考虑产品的范围,不能随便写Medical mask。产品的说明书以及标签如果超出产品的认证范围,注册时有风险。
4) 企业在选择认证途径时一定考虑产品的市场,在欧洲个人防护用品和医用商品的销售途径不同,个人防护用品很难进入药店和医疗机构的。
5) 关于PPE产品,目前市面上很多86/866/EEC的证书,该法规已经取消,所以此类的证书也是无效的,产品无法销售欧洲。


4、MDD class I 认证及风险点:
1) MDD Class I自我符合性声明途径是I类医疗器械认证的法定途径,这是欧洲法规不容质疑。针对目前第三方机构发放的符合性声明,请企业一定要确认符合性声明上写的产品标准是否为欧洲标准;如果不是,产品可能会出销售的问题。
2) 根据MDD,自我符合性声明是要企业严格进行临床前评估和临床评价的,因此产品安全性和有效性的检测符合欧洲的标准:EN14683或EN149。
3) 对于目前国内按国标检测的产品,按照欧洲的要求应该需要重新进行检测,但欧洲对性能检测的机构的资质并没有要求,检测的报告的合规性主要看检测方法以及检测的Criteria是否符合要求。
4) 目前国内企业想短期内在欧洲进行产品注册,实现这一目的的前提是:有成品/原材料的生物相容性报告,在具备性能检测设备或相应的工厂、实验室进行产品性能检测,完成产品的老化测试(如果有效期为2年,老化测试的时间2个月左右)及包装验证。
5) 不管在欧洲哪个国家注册,对产品的标签和说明书都是有相应的要求的,因此在企业考虑CE认证之前请联系欧代,让欧代提供产品标签和说明书的要求。
| 上海沙格企业管理咨询有限公司广州分公司 | |||
|---|---|---|---|
| 联系人 | 王瑞芬 |
微信 | 无 |
| 手机 | ����������� | 邮箱 | 81042498@qq.com |
| 传真 | 无 | 地址 | 广州市天河区天河北路620号2604房,2603房(仅限办公用途) |
| 主营产品 | 美国fda注册,欧盟ce认证 | 网址 | /qiye2884368/ |