产品单价 |
1.00元 |
起订量 |
1000 |
供货总量 |
10000 |
发货期限 |
自买家付款之日起3天内发货 |
品牌 |
英代 |
UKCA流程 |
英国注册MHRA |
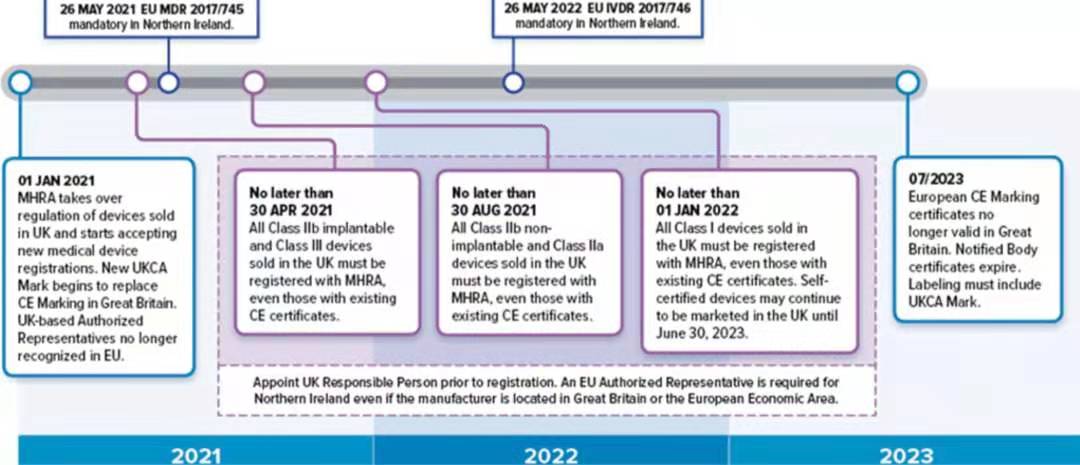
时间即将来到了2021年1月,英国脱欧的过渡期即将结束。很多客户问询英代和英国注册的流程。
英国注册就是MHRA注册,全称是Medicines and Healthcare products Regulatory Agency 医药和健康产品管理局。在英国脱欧后,医疗器械的上市前和上市后的监管都由MHRA主管。
在2021年1月1日英国脱欧过渡期结束后,所有的医疗器械,体外诊断医疗器械都需要在MHRA注册。因此收影响的是MDD中的IIA,IIB ,III类的医疗器械,以及IVDD中的List A和 List B 的器械。MHRA注册对于这些器械来说是新要求。

MHRA只手里英国制造商或者位于英国的法规负责人(UK Responsible Person)的注册申请。因此位于英国境外的制造商,如果要完成MHRA注册,先英国法规负责人,然后由英国法规负责人来完成注册。英国法规负责人的概念和大家较为熟悉的欧盟授权代表类似。

那么各类医疗器械的英国注册时间要求如何呢?
MHRA对于器械注册给出了总时间为一年的缓冲期。其中高风险器械需要在4月30日之前注册完毕,次高风险的器械需要在8月30日前注册完毕,低风险器械需要在2021年1月1日前注册完毕。
**MHRA英国注册需要哪些资料?
一:制造商信息:
1)注册地址
2)公司名称
3)公司类型(有限公司还是个体从业者)
4)联系人信息
5)英国法规负责人的书面协议(适用时)
二:器械信息
1)适用的法规
2)器械分类
3)器械的GMDN代码
4)型号或者版本
5)目录号/参考号
6)UDI-DI(适用时)
7)UK认证机构(或者欧盟公告机构),适用时
8)特征,例如灭菌与否,是否含有乳胶,是否MRI兼容。
同时基于申报器械的类别,你还需要递交合格评定证书,符合性申明,或者定制器械申明。
英国注册MHRA作为加贴UKCA标志确保产品持续合规的出口英国的关键一步,需要制造商的英国法规负责人来实施。同时还需要准备符合UK MDR 2002的技术文件,必要时注册还需要提供符合性申明和公告机构证书。
| 上海沙格企业管理咨询有限公司广州分公司 | |||
|---|---|---|---|
| 联系人 | 王瑞芬 |
微信 | 无 |
| 手机 | ����������� | 邮箱 | 81042498@qq.com |
| 传真 | 无 | 地址 | 广州市天河区天河北路620号2604房,2603房(仅限办公用途) |
| 主营产品 | 美国fda注册,欧盟ce认证 | 网址 | /qiye2884368/ |