产品单价 |
面议 |
起订量 |
1 |
供货总量 |
不限量 |
发货期限 |
自买家付款之日起3天内发货 |
品牌 |
瑞士代表 |
CHREP |
瑞代 |
瑞士对于医疗器械的管理规定和欧盟基本相同。依据器械分类不同采取自我宣告和合格 评定两种模式,其中合格评定认可欧盟公告机构的证书或者瑞士认证机构的评定证书。
在2021年5月26日之前,非欧盟国家向瑞士出口医疗器械时,需要欧盟授权代表就可以满足要求。
但是从2021年5月26日之后,出口瑞士需要单瑞士代表(CH-REP)。
》》什么是瑞士代表?
瑞士代表的定义:任何在瑞士境内成立的自然人或法人已收到并接受位于瑞士境外的制造商的书面授权,以代表制造商就其在医疗器械条例下的义务的特定任务采取行动。
为了能够履行必要的职责,瑞士代表应其法规负责人PRRC。同时瑞士代表应确保具备充分的知识以应对器械上市前和上市后的各项工作。
另外,按照瑞士法规要求,瑞士代表也需要在对瑞士的医疗器械贸易发生后的三个月内完成其CHRN的注册。
PART2
什么时候需要瑞士代表?
2.1 制造商在欧盟/欧洲经济区内或者了欧盟授权代表
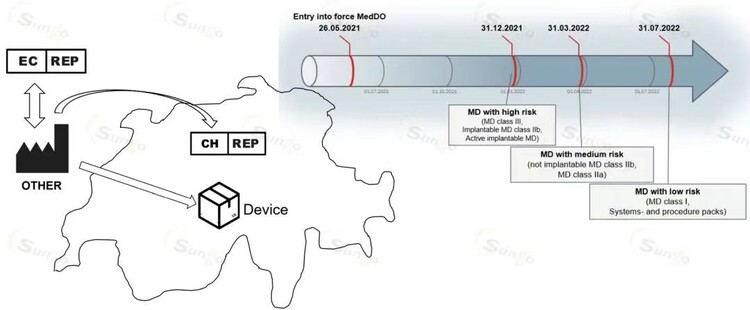
此时制造商享有过渡期,在过渡期截止日期之前瑞士代表即可。
对于III类器械、IIb类植入式器械和有源植入式器械:
2021年12月31日
对于非植入式IIb类设备和IIa类设备:
2022年3月31日
对于I类设备:
截至2022年7月31日
对于系统和程序包在2022年7月31日名符合51条5款的授权代表。
2.2 如果制造商不在欧盟或欧洲经济区内,同时又没有在2021年5月26日之前欧盟授权代表的制造商,应在2021年5月26日或者进行瑞士医疗器械贸易时瑞士代表。
图2 不能享受过渡期图示
PART3瑞士代表的职责有哪些?
瑞士代表的职责包括如下内容:
1) 在瑞士境内注册的机构,配备合规负责人PRRC,并完成了CHRN代码的注册;
2) 瑞士代表应和制造商签定书面的瑞士代表协议以约定双方的职责权限;
3) 对投放市场的产品程序和安全性上合规进行必要的确认,包括检查技术文件、DoC、公告机构证书以及注册义务等;
4) 应负责保留制造商的技术文件,当主管当局需要时应在7天内提供;技术文件保留10年,植入性器械保留15年。
5) 及时将投诉和事故信息传递给制造商;确认FSCA以及FSN及时提交给当局;配合当局实施预防措施和纠正措施。
出口瑞士的医疗期器械厂家,为了避免清关出现问题,请及时办理瑞士代表瑞士注册。
对于自我宣告类产品: 1) 编制技术文件和 DOC; 2) 瑞士代表,并将 1)和 2)文件提交瑞代; 3) 标签/说明书/外包装/器械伴随文件等加贴瑞代信息; 4) 产品出口以及上市后管理。
对于合格评定(非自我宣告类)产品: 1) 编制技术文件和 DOC; 2)提供 MDR/IVDR 的 CE 证书或者瑞士认证机构的评定证书; 3) 瑞士代表,并将 1)和 2)文件提交瑞代; 4) 标签/说明书/外包装/器械伴随文件等加贴瑞代信息; 5) 产品出口以及上市后管理。
| 上海沙格企业管理咨询有限公司广州分公司 | |||
|---|---|---|---|
| 联系人 | 王瑞芬 |
微信 | 无 |
| 手机 | ����������� | 邮箱 | 81042498@qq.com |
| 传真 | 无 | 地址 | 广州市天河区天河北路620号2604房,2603房(仅限办公用途) |
| 主营产品 | 美国fda注册,欧盟ce认证 | 网址 | /qiye2884368/ |



